Abstract
Purpose
Many cases have been reported of hemodynamic and airway collapse induced by general anesthesia in patients with an anterior mediastinal mass. We examined the literature for predictors of perioperative risk, guidelines for preoperative investigations, and strategies for management of the patient with a mediastinal mass.
Principal findings
In patients with an anterior mediastinal mass, symptoms may range from none to severe and may include orthopnea, stridor, cyanosis, jugular vein distension, or superior vena cava syndrome. In limited case series, incidences of serious complications up to 20% were noted, but these are primarily pediatric studies with unclear relevance to adults. There is a paucity of evidence providing guidance on quantifying risk and planning the safe conduct of anesthesia. In the largest adult case series to date, intraoperative complications were associated only with the preoperative presence of a pericardial effusion. Postoperative complications were predicted by severe symptoms at presentation, tracheal compression of > 50%, and a mixed obstructive-restrictive picture on pulmonary function testing. Low-risk patients tolerate conventional general anesthesia with neuromuscular blockade and positive pressure ventilation. Those at intermediate or high risk are best managed with the maintenance of spontaneous ventilation, at least initially. Cardiopulmonary bypass remains the option of last resort.
Conclusions
It appears prudent to avoid general anesthesia when possible for patients at the highest risk. When general anesthesia is required, a comprehensive plan must be formulated preoperatively with the surgical team. Cardiopulmonary bypass requires time for implementation, so it should be considered early and appropriate preparations should be made prior to the initiation of anesthesia.
Résumé
Objectif
De nombreux cas d’affaissement des voies aériennes et d’effondrement hémodynamique induits par l’anesthésie générale ont été rapportés chez des patients présentant une masse médiastinale antérieure. Nous avons passé en revue la littérature afin d’identifier des prédicteurs de risque périopératoire, les recommandations d’examens préopératoires et les stratégies de prise en charge des patients présentant des masses médiastinales.
Constatations principales
Chez les patients présentant une masse médiastinale antérieure, les symptômes peuvent aller d’inexistants à graves et pourraient inclure l’orthopnée, le stridor, la cyanose, la distension de la veine jugulaire et un syndrome de la veine cave supérieure. Dans des séries de cas limitées, une incidence de complications graves allant jusqu’à 20 % a été notée; toutefois, il s’agit principalement d’études pédiatriques dont la pertinence chez l’adulte n’est pas claire. Il existe peu de données probantes qui conduisent à des recommandations quant à la quantification du risque et à la planification d’une anesthésie sécuritaire. Dans la plus importante série de cas chez l’adulte à ce jour, des complications peropératoires n’ont été associées qu’avec la présence préopératoire d’un épanchement péricardique. Parmi les prédicteurs de complications postopératoires figuraient les symptômes graves lors de l’admission, une compression trachéale > 50 %, et des résultats obstructifs-restrictifs mixtes lors de l’examen de la fonction pulmonaire. Les patients à faible risque tolèrent l’anesthésie générale conventionnelle avec bloc neuromusculaire et ventilation en pression positive. Chez les patients présentant un risque modéré ou élevé, une prise en charge optimale consiste à maintenir la ventilation spontanée, au moins au début. La circulation extracorporelle demeure l’option de dernier recours.
Conclusion
Il semble prudent d’éviter, dans la mesure du possible, l’anesthésie générale chez les patients à risque très élevé. Lorsque l’anesthésie générale est nécessaire, un plan détaillé doit être élaboré avant l’opération, de concert avec l’équipe chirurgicale. La mise en œuvre d’une circulation extracorporelle requiert du temps, c’est pourquoi elle doit être envisagée tôt et une préparation adaptée doit être faite avec le début de l’anesthésie.
Similar content being viewed by others
Objectives of this Continuing Professional Development (CPD) module
After reading this module, the reader should be able to:
-
1.
Understand the anatomy of the anterior mediastinum.
-
2.
Recognize the common presenting symptoms of an anterior mediastinal mass.
-
3.
Stratify patients according to risk based on symptoms and preoperative testing.
-
4.
Avoid general anesthesia when appropriate.
-
5.
Formulate an anesthetic plan that emphasizes the maintenance of spontaneous ventilation.
-
6.
Appreciate the appropriate role of cardiopulmonary bypass.
Anesthetic management in both children and adult patients with an anterior mediastinal mass is fraught with the potential for cardiorespiratory collapse.1-4 The focus of this review is on the management of adult patients with a significant mediastinal mass. We present a discussion of the pertinent pathophysiologic principles and an evidence-based approach to anesthetic management.
Anatomy, presentation, and pathophysiology
The anterior mediastinum is spatially defined by the sternum anteriorly, the middle mediastinum comprising the heart and great vessels posteriorly, the thoracic inlet superiorly, and the diaphragm inferiorly (Fig. 1). Anterior mediastinal masses may be benign or malignant and may arise from the thymus, thyroid, lung, airway, pleura, pericardium, lymphatic, and other tissues (Table). As the mass enlarges, clinical signs and symptoms may result from the compression of vital structures. Compression of the trachea or mainstem bronchi may result in cough and dyspnea; involvement of the superior vena cava (SVC) may result in SVC syndrome; compression of the esophagus leads to dysphagia; impingement of the recurrent laryngeal nerve causes hoarseness; and direct compression of the heart, with or without an associated pericardial effusion, may result in cardiac tamponade with syncope or postural symptoms.5 Symptoms may also arise from the systemic effects of the mass or from the disease process associated with such masses. For example, lymphoma may be associated with fever, night sweats and weight loss, thymic tumours with myasthenia gravis, and thyroid masses with hyperthyroidism. Frequently, the only symptom may be chest pain or fullness.
Preoperative assessment
Evaluation of risk
The preoperative assessment is directed at identifying the signs and symptoms that predict perioperative risk. It is especially important to elicit a history of dyspnea, particularly if a postural component is present. Positional dyspnea or orthopnea and stridor are potentially ominous signs and may predict the degree of tracheal compression,6 pulmonary function abnormalities,7 and the likelihood of complications.7-10 If postural symptoms are identified, an effort should be made to define the position(s) in which symptoms are minimized. Cardiovascular symptoms may result from compression of the SVC,11 pulmonary arteries,2,12,13 or the heart itself.5,12 A paradoxical decrease in blood pressure occurring with a change in position from upright to supine may indicate significant obstruction to right ventricular filling or ejection. Plethora of the head and neck and prominent cutaneous veins may suggest SVC syndrome, a risk factor for perioperative complications.8,9 Jugular venous distension may also be present in SVC syndrome, but in the absence of plethora of the head and neck, a pericardial effusion with possible tamponade physiology should be suspected.
Once a chest radiograph confirms the presence of an anterior mediastinal mass, a computed tomography (CT) scan of the chest is required to define the position and size of the mass. If chest imaging suggests a pericardial effusion or compression of the heart or a major vascular structure, echocardiography is indicated to delineate the effect on cardiovascular function. Echocardiography is specifically indicated in the diagnosis and intraoperative evaluation of hemodynamic instability and management of pericardial effusion. It may also be instrumental in the identification and diagnosis of mediastinal masses14 and their impact on cardiac chambers.12,14 However, potential benefits of intraoperative transesophageal echocardiography should be balanced against the risks of esophageal injury and posterior tracheal compression.
Spirometry
Measurement of respiratory gas flow in the upright and supine positions has been widely recommended in the anesthesiology literature. Intrathoracic airway obstruction is accompanied by a widening of the mid-expiratory plateau and is thought by some investigators to predict risk for intraoperative airway compromise.15 Although abnormalities in air flow accompany severe tracheal obstruction in patients with mediastinal masses,16,17 classical blunting of the expiratory limb does not appear to be pathognomonic for variable intrathoracic airway obstruction16 and has not been shown to predict complications.18
As suggested by Bechard et al. in an adult case series, formal pulmonary function testing (PFT) might contribute to risk prediction or perioperative management of patients with a mediastinal mass. They reported that a mixed obstructive and restrictive pattern on PFT predicted a greater rate of postoperative respiratory complications by multivariate analysis.8 Taken together with results from the pediatric literature, it appears that decrements in pulmonary function result primarily from compression of pulmonary parenchyma, and these may lead to an increased incidence of postoperative complications, such as atelectasis and pneumonia. For a mediastinal mass to be both obstructive and restrictive, it must be large enough to compress a significant amount of lung parenchyma while also compressing the trachea and/or mainstem bronchi. Thus, PFT may be a surrogate for both the size and location of the mass, information which is derived more easily from the chest CT scan. It remains unclear whether PFT adds to preoperative risk stratification or improves anesthetic management.
Tracheal compression
Symptomatic and/or radiographic evidence of tracheal compression is of great concern to the anesthesiologist, as it is felt to be associated with an increased risk of intraoperative airway compromise. The literature is replete with examples of patients with mediastinal masses who suffered from severe or even fatal intraoperative airway compromise. Patients with a > 50% decrease in tracheal cross-sectional area (CSA) are more likely to be symptomatic6 and suffer from perioperative complications,8,19 whereas a tracheal CSA of > 50% of normal appears to be associated with a low incidence of respiratory complications.17,20 Not surprisingly, the “safe” lower limit of tracheal CSA varies between studies and other lower limits have been proposed.10 Definitive risk stratification on the basis of tracheal CSA and other potentially predictive factors is limited by the understandable tendency of most practitioners to modify anesthetic management or avoid general anesthesia completely in patients with the most severe findings. The lower limit of tracheal CSA compatible with the safe administration of general anesthesia is likely to vary based on patient characteristics, co-morbidities (e.g., chronic respiratory disease), as well as the size and positional relationship of the mass to the airway. Concomitant compression of the mainstem bronchi may also significantly affect perioperative risk. In a recent study, Hack et al. found respiratory complications in only those children with tracheal CSA < 30% of normal or tracheal CSA < 70% if there was coexistent bronchial compression.10 Moreover, the combination of left mainstem bronchial compression and right pulmonary artery compression has been reported to cause catastrophic complete ventilation-perfusion mismatch.2,13
Anesthetic plan
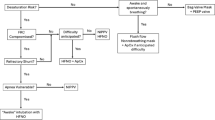
An individualized perioperative care plan should be formulated for each patient based on the available clinical, radiographic, and other data. Moreover, this plan should be multidisciplinary in nature, including the anesthesiologist, surgeon, and intensivist. It may also be important to involve an oncologist, radiation oncologist, or interventional radiologist in selected cases. Though it is not yet possible to assess the risk of perioperative complications precisely, it is probably reasonable to stratify patients into broad risk categories based on the statistical association of risk characteristics and our general understanding of thoracic and mediastinal physiology. Such risk stratification strategies have been previously proposed.3,10,15 We use the following approach to classify patients:
-
Low risk: Asymptomatic or mildly symptomatic, without postural symptoms or radiographic evidence of significant compression of structures;
-
Intermediate Risk: Mild to moderate postural symptoms, tracheal compression < 50%;
-
High risk: Severe postural symptoms, stridor, cyanosis, tracheal compression > 50% or tracheal compression with associated bronchial compression, pericardial effusion or SVC syndrome.
Pathophysiology of mediastinal masses
The pathophysiologic consequences of mediastinal masses are due primarily to the competition for mediastinal space with structures of vital physiologic significance, namely, the heart, pulmonary arteries, great veins, lungs, and major conducting airways. Anesthesia and associated interventions, such as neuromuscular blockade and positive pressure ventilation, may exert profound effects on this balance. The decrease in functional residual capacity (FRC) associated with general anesthesia is approximately 20%,21 and this likely reflects effects on inspiratory muscle tone, elastic recoil of the chest wall, and cephalad displacement of the diaphragm. The loss of spontaneous ventilatory activity decreases the transpleural pressure gradient which, under normal conditions, serves to distend intrathoracic airways and prevent collapse. This is particularly true during the expiratory phase when pleural pressures increase, potentially worsening airway compression at the site of impingement. Positive pressure ventilation may further exaggerate increases in intrathoracic pressure associated with anesthesia. This postulate is supported by observations that human mediastinal pressures are significantly lower with ventilatory modes involving spontaneous ventilation.22
Hemodynamic compromise may result from compression of major cardiovascular structures. Diminished cardiac output may result from compression of the SVC, pulmonary arteries, or the heart itself. Direct compression of the heart anteriorly more likely involves the right heart,23 particularly the right ventricle and the outflow tract,12 whereas the left heart is more likely to be compressed posteriorly.5,24 In a canine model of an anterior mediastinal mass under anesthesia, the decrease in cardiac index was shown to be due primarily to an increase in right ventricular afterload, the end result of which was decreased left ventricular stroke volume via an effect on ventricular interdependence.25 Direct myocardial compression may result in a tamponade-like syndrome by impeding diastolic filling of the cardiac chambers, a process which may be exacerbated by coexistent pericardial effusion, a risk factor for complications.8
Clinically significant compression of structures may also occur from masses in the posterior mediastinum. Compression of the left heart is known to occur by masses in the posterior mediastinum.5,24 Esophageal masses, the dilated esophagus itself, tumours, and other masses within the posterior mediastinum may also cause tracheal compression or deviation. Since the posterior tracheal wall is unsupported by cartilage, it may be more susceptible to rapid compression by masses in this position, potentially resulting in severe tracheal obstruction.
Anesthesia for diagnostic procedures
Given that lymphoma and other malignancies may present as mediastinal masses and require non-surgical therapy, the anesthesiologist is frequently challenged to provide a safe anesthetic to facilitate surgical biopsy. It is important that the anesthesiologist be involved in the decisions regarding risks and benefits of possible biopsy approaches. For intermediate and high-risk patients, the avoidance of general anesthesia is a reasonable and worthwhile goal until and unless other options have been excluded.
Percutaneous needle biopsy using CT guidance obviates surgical biopsy in most cases. Orthopnea is not likely to preclude the procedure, since this can usually be done with 20-30° of head elevation. Any extra-thoracic source of a tissue diagnosis, such as pleural effusion or palpable lymphadenopathy, should be sampled using local anesthesia. Even when a surgical biopsy is required, general anesthesia may often be avoided. Masses within the anterior and superior mediastinum are readily accessible using a small anterior mediastinotomy approach. This procedure can be performed under local anesthesia and may produce diagnostic accuracy superior to that achieved by needle biopsy.26 Mediastinoscopy and thoracoscopy can also be performed under local anesthesia in motivated patients.27,28 The avoidance of general anesthesia and the use of local anesthesia alone or in combination with sedation has been reported in clinical series of adults8 and children7,10 with mediastinal masses.
Consideration should also be given to treatment with corticosteroids, chemotherapy, or radiation prior to biopsy in order to achieve symptomatic relief and improve the safety of general anesthesia. Unfortunately, empiric treatment prior to definitive tissue diagnosis could compromise the pathologic diagnosis and ultimate therapeutic success. However, this view is not universal and institutional practices vary. In patients with severe airway compromise whose treatment is non-surgical, airway stenting can be performed as a temporizing measure.
Management of general anesthesia
The case literature indicates a lack of serious complications in patients with low-risk characteristics. These patients can be given general anesthesia safely with positive pressure ventilation and standard monitoring. Intermediate and high-risk patients need individualized management based on their preoperative symptoms and radiologic studies. Invasive arterial monitoring in these patients is mandatory because of the potential for cardiorespiratory instability. If there is preoperative evidence of SVC syndrome, large bore intravenous access must be secured in a lower extremity.
Review of evidence
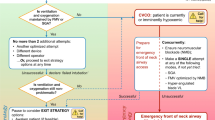
We agree with previous authors9,15,29 who have stressed the importance of maintaining spontaneous ventilation in high-risk patients undergoing surgical procedures. Virtually all the reported cases of severe complications have occurred in the absence of spontaneous ventilation. Case reports are inherently biased, however, and tend to focus on the most severely affected patients and often the most catastrophic outcomes. Moreover, the clinical efficacy of maintaining spontaneous ventilation in the context of high-risk mediastinal masses cannot be tested in a controlled fashion in human patients. Thus, clinical evidence in support of this management approach comes primarily from two lines of evidence: 1) case reports and series in which the cardiorespiratory compromise followed neuromuscular blockade and/or positive pressure ventilation;30-33 and 2) reports23,34-37 and series8,9,17,19,33 in which high-risk patients managed with spontaneous ventilation (general anesthesia or local anesthesia with sedation) avoided serious complications. Taken together with pathophysiologic principles discussed above, the bulk of available evidence supports the maintenance of spontaneous ventilation during general anesthesia. In most cases, positive pressure ventilation and neuromuscular blockade may be instituted safely after surgical decompression of the mediastinum via sternotomy.
Airway management
The airway can be secured with awake fibreoptic bronchoscopy using local anesthesia supplemented either by judicious intravenous sedation or after an inhalational induction and conventional laryngoscopy. The chosen method should minimize the risks of upper airway obstruction, breath holding, and laryngospasm, which may be detrimental in the presence of tracheobronchial obstruction. In the presence of a significant pericardial effusion, cardiac compression, or other causes of cardiovascular compromise, spontaneous ventilation may not be sufficient to counteract the hemodynamic effects of deep volatile anesthesia.
The appropriate strategy for airway management is defined by the anatomy of tracheo -bronchial obstruction. Tracheal compression with an adequate segment of normal distal trachea usually permits the placement of an appropriately sized reinforced endotracheal tube beyond the site of obstruction. However, if the distal trachea, carina, and/or both mainstem bronchi are compressed, it may not be possible to pass an endotracheal tube beyond the obstruction. In these situations, placing an endotracheal tube proximal to the obstruction cannot be regarded as definitively securing the airway. Traditionally, rigid bronchoscopy has been advocated as a method to secure the airway when an endotracheal tube cannot be advanced past the site of airway obstruction. However, this technique may be difficult or impossible in the patient with cervical spine immobility or with unfavourable upper airway anatomy. For these high-risk cases, appropriate planning should include the possibility of airway loss.
Spontaneous ventilation
Maintenance of spontaneous ventilation via an endotracheal tube should be continued while achieving a surgical level of anesthesia. The intravenous agents, dexmedetomidine and ketamine, may be useful in this context as they have analgesic and sedative properties with minimal respiratory depression. The anesthesiologist must be prepared for emergency airway maneuvers should ventilation become difficult prior to resection of the mass. Options include rapidly awakening the patient, shifting the patient to a preplanned “rescue” position, or utilizing rigid bronchoscopy for ventilation.
“Rescue” position
Significant difficulty in ventilating the patient can be managed by rapid institution of a “rescue” position which may ameliorate signs of impending respiratory collapse.38,39 Ideally, the correct “rescue” position should be determined preoperatively and chosen on the basis of the anatomic relationship between the mass and the compressed structure and improvement in symptoms in specific positions. “Rescue” positions may include upright seated, lateral decubitus,38,39 or prone positions depending on the anatomic relationship between the mass and the airway. Recourse to rigid bronchoscopy and a physician skilled in its use may be necessary in the event of airway loss. The bronchoscope can be placed beyond a mid-tracheal narrowing or placed into a patent mainstem bronchus. Anesthesia can be maintained intravenously and respiration maintained spontaneously or with jet ventilation. With the tracheo-bronchial anatomy visualized, a decision can then be made to: continue with ventilation via the rigid bronchoscope, place a single or double lumen endotracheal tube under direct vision, or await the return of spontaneous ventilation. Severe hypotension may also require a rapid positional change to the “rescue” position. Mild to moderate decreases in cardiac output may respond to a lightened depth of anesthesia and the basic principles of cardiac tamponade management, including plasma volume expansion and/or treatment with vasopressor or inotrope. Unresponsiveness to these measures will require an immediate sternotomy to elevate the mass from the compromised structures.
Helium-oxygen
In cases of severe tracheo-bronchial compression, decreased respiratory gas flow may result, in part from an increase in turbulence distal to the site of obstruction. Helium-oxygen mixtures (heliox) have been used widely in patients with obstruction to promote laminar gas flow. The use of heliox has also been described in patients with critical airway obstruction from large mediastinal masses, and it may provide symptomatic improvement37 as well as facilitate the induction of general anesthesia36,37 and weaning from ventilator support.40 Salutary effects of heliox with regard to laminar gas flow require high helium fractions and thus limit the inspiratory concentration of oxygen. Potential benefits of improved distal tracheo-bronchial gas flows in patients with severe compromise and/or respiratory distress should be weighed against the disadvantage of limiting the inspired oxygen fraction, particularly in hypoxemic patients.
Cardiopulmonary bypass
The final option in the management algorithm for a critical mediastinal mass is cardiopulmonary bypass (CPB). The time required for emergent cannulation and institution of full CPB is likely to vary significantly based on several factors, including the experience of the surgeon and the degree to which preparations have been made. Though reports of emergent CPB resulting in the rescue of patients from complete hemodynamic or respiratory collapse exist,2,4,13 it seems unlikely that completely unplanned CPB can be relied on in this scenario. Even with a primed CPB circuit and a cardiac surgeon and perfusionist in the operating room, the ischemic interval during emergent cannulation and institution of full CPB is likely to result in significant neurologic injury.
Preoperative preparation for CPB should be considered in the highest-risk patients. If other salvage techniques are unlikely to be successful (e.g., severe distal tracheal and/or bilateral mainstem bronchial compression), cannulation should occur prior to the induction of anesthesia. It is not entirely clear whether an intermediate level of preparation for CPB (e.g., surgical exposure of the femoral vessels or cannulation of these vessels with small calibre cannulae to facilitate a more rapid definitive cannulation) is likely to shorten the ischemic interval sufficiently in the event of hemodynamic or respiratory collapse.
The available evidence suggests that complications from mediastinal mass effect are also likely to occur in the postoperative period.8,10 Pneumonia, airway obstruction secondary to edema, and atelectasis are the most common manifestations and tend to occur within the first 48 hr.8 Long-standing masses may cause tracheomalacia leading to airway obstruction. Resection of large complex masses may be technically difficult, require long operative periods, and potentially involve significant blood loss and fluid shifts. It is prudent in these situations to consider a period of postoperative ventilation.
Summary
The patient with a large anterior mediastinal mass presents a considerable challenge to the anesthesiologist. The avoidance of general anesthesia for diagnostic procedures is recommended, particularly when symptoms are severe. The maintenance of spontaneous ventilation with general anesthesia is the cornerstone of management in high-risk patients. High-risk patients requiring general anesthesia for resection require a careful individualized anesthetic plan with multiple therapeutic options readily available to prevent or manage cardiorespiratory complications.
Clinical case
Patient consent was obtained for publication. A 49-yr-old male underwent anterior cervical discectomy and fusion surgery. He weighed 100 kg and had no medical history other than cervical disc disease. There were no preoperative symptoms, and no preoperative chest imaging was performed. He received a balanced general anesthetic with neuromuscular blockade and positive pressure ventilation. The surgeon noted an enlarged thyroid gland which complicated the exposure of the anterior cervical vertebral bodies. Manipulation and retraction of the thyroid gland was required to complete the procedure successfully. The patient recovered uneventfully and was discharged home. Now, on the fifth postoperative day, the patient presents with cough and dyspnea. Chest radiography and computed tomography reveal a large anterior mediastinal mass originating from his neck, which is likely a mediastinal goitre. There is severe tracheal compression and deviation, and there is also compression of the innominate vein but no pericardial effusion (Figs. 2, 3, 4, 5). The patient is urgently transferred to the authors’ institution. The patient is dyspneic, tachycardic, and hypertensive. Oxygen saturation (SpO2) is initially 98% on room air, but over the course of four hours in the emergency department, he develops an oxygen requirement of 4 L·min−1 to maintain a SpO2 of 94%. During frequent bouts of coughing, the SpO2 decreases to < 85%. Severe orthopnea requires the patient to sit fully upright. An arterial cannula is placed in the right radial artery revealing a 30 mmHg pulsus paradoxus. He is urgently brought to the operating room for resection of the mass. A sternotomy and anterior neck dissection is planned for complete excision of the mass.
Chest radiograph. Large anterior mediastinal mass causing extreme compression and rightward deviation of the trachea. The compressed mid-tracheal segment measures 3.2 cm in length (thick arrow). The distal trachea is of normal calibre over a length of 4.3 cm (thin arrow)
Fig. 2 Radiographie des poumons. Masse médiastinale antérieure de taille importante provoquant une compression extrême et une déviation vers la droite de la trachée. Le segment mi-trachéal comprimé mesure 3,2 cm de long (flèche en gras). La trachée distale est de calibre normal sur une longueur de 4,3 cm (flèche fine)
Chest computed tomography scan. The thin arrow indicates the trachea at its point of maximal compression. The reduction in cross-sectional area is estimated to be 80%. The thick arrow points to the mediastinal mass, which is heterogeneous in nature, suggesting recent hemorrhage
Fig. 3 Tomodensitogramme des poumons. La flèche fine indique la trachée à son point de compression maximale. La réduction de l’aire transversale est estimée à 80 %. La flèche en gras pointe vers la masse médiastinale, de nature hétérogène, ce qui indique une hémorragie récente
Coronal reconstruction of the chest computed tomography scan. The black arrow shows that the mass originates in the neck and is likely of thyroid origin
Fig. 4 Reconstruction coronale du tomodensitogramme des poumons. La flèche noire montre que la masse prend son origine dans le cou et est probablement d’origine thyroïdienne
Chest computed tomography scan. The white arrow points to the innominate vein, and the black arrow indicates compression of the vein between the mediastinal mass and the aortic arch. MM = mediastinal mass; AA = aortic arch; S = superior vena cava
Fig. 5 Tomodensitogramme des poumons. La flèche blanche pointe vers la veine brachio-céphalique et la flèche noire indique une compression de la veine entre la masse médiastinale et la crosse de l’aorte. MM = masse médiastinale; AA = crosse de l’aorte; S = veine cave supérieure
Instructions for completing the continuing professional development (CPD) module
-
1.
Read the current article and the references indicated in bold.
-
2.
Go to: https://www.cpass2.umontreal.ca/selfassessmentprogram/ and select the current module (Anesthetic management of patients with an anterior mediastinal mass).
-
3.
Answer the multiple choice questions regarding the case scenario.
-
4.
Once you have entered all of your answers, you will have access to experts’ explanations for all the possible choices.
-
5.
Participants may claim up to four hours of CPD, for a total of 12 credits under Section 3 of the CPD program of the Royal College of Physicians and Surgeons of Canada.
Objectifs de ce module de développement professionnel continu (DPC)
Après avoir lu ce module, le lecteur devrait être en mesure de:
-
1.
Comprendre l’anatomie du médiastin antérieur.
-
2.
Reconnaître les symptômes courants associés à une masse médiastinale antérieure.
-
3.
Classifier les patients selon le risque en se fondant sur leurs symptômes et les tests préopératoires.
-
4.
Éviter l’anesthésie générale lorsque cela est indiqué.
-
5.
Élaborer un plan pour l’anesthésie qui met l’accent sur le maintien de la ventilation spontanée.
-
6.
Évaluer le rôle adéquat de la circulation extracorporelle.
La prise en charge de l’anesthésie chez les enfants et les adultes présentant une masse médiastinale antérieure comporte le risque potentiel de collapsus cardio-respiratoire.1-4 Ce compte-rendu se concentrera sur la prise en charge des patients adultes présentant une masse médiastinale importante. Nous discuterons des principes physiopathologiques pertinents et présenterons une approche de la prise en charge de l’anesthésie fondée sur des données probantes.
Anatomie, présentation et physiopathologie
Le médiastin antérieur est défini dans l’espace par le sternum, situé devant, le médiastin moyen, qui comprend le cœur et les grands vaisseaux, situé derrière, l’orifice supérieur du thorax au-dessus et le diaphragme, au-dessous (Fig. 1). Les masses médiastinales antérieures peuvent être bénignes ou malignes et peuvent provenir des tissus du thymus, de la thyroïde, des poumons, des voies aériennes, de la plèvre, du péricarde, du système lymphatique ou autres (voir Tableau). Au fur et à mesure que la masse grandit, des signes cliniques et des symptômes peuvent être provoqués par la compression de structures vitales. La compression de la trachée ou des bronches souches peut causer de la toux et une dyspnée; lorsque la veine cave supérieure (VCS) est touchée, il peut y avoir syndrome de la VCS; la compression de l’œsophage entraîne une dysphagie; un pincement du nerf laryngé récurrent provoque raucité de la voix; et la compression directe du cœur, avec ou sans épanchement péricardique associé, peut causer une tamponnade cardiaque accompagnée de syncope et de symptômes posturaux.5 Des symptômes peuvent également être causés par les effets systémiques de la masse ou de l’évolution de la maladie associée à de telles masses. Par exemple, un lymphome peut être associé à de la fièvre, des sueurs nocturnes et une perte de poids, les tumeurs du thymus à une myasthénie grave, et des masses thyroïdiennes à de l’hyperthyroïdisme. Souvent, le seul symptôme est une douleur thoracique ou une sensation de pesanteur.
L’évaluation préopératoire
Évaluation du risque
L’évaluation préopératoire a pour objectif d’identifier les signes et symptômes qui permettent de prédire un risque périopératoire. Il est particulièrement important d’obtenir les antécédents de dyspnée du patient, particulièrement si les symptômes comportent une composante posturale. La dyspnée ou l’orthopnée de position et le stridor sont des signes potentiellement inquiétants et pourraient être des prédicteurs du degré de compression trachéale,6 des anomalies au niveau de la fonction pulmonaire,7 et de la possibilité de complications.7-10 Si des symptômes posturaux sont identifiés, il faut, dans la mesure du possible, définir la/les position(s) dans laquelle/lesquelles les symptômes sont minimisés. Les symptômes cardiovasculaires peuvent être provoqués par une compression de la VCS,11 des artères pulmonaires,2,12,13 ou du cœur lui-même.5,12 Une réduction paradoxale de la pression artérielle survenant lors d’un changement de position de verticale à couchée pourrait indiquer une obstruction importante du remplissage ou de l’éjection du ventricule droit. Un engorgement au niveau de la tête et du cou et des veines cutanées proéminentes pourrait signaler un syndrome de la VCS, un facteur de risque de complications périopératoires.8,9 Une distension de la veine jugulaire pourrait également être observée en cas de syndrome de la VCS, mais en l’absence d’engorgement au niveau de la tête et du cou, un épanchement péricardique accompagné possiblement d’une physiologie de tamponnade devrait être envisagé.
Une fois qu’une radiographie pulmonaire confirme la présence d’une masse médiastinale antérieure, il convient de réaliser un tomodensitogramme des poumons afin de déterminer l’emplacement et la taille de la masse. Si l’imagerie pulmonaire indique un épanchement péricardique ou une compression du cœur ou de l’une des principales structures vasculaires, il faut réaliser une échocardiographie afin de déterminer son effet sur la fonction cardiovasculaire. L’échocardiographie est particulièrement indiquée pour le diagnostic et l’évaluation peropératoire de l’instabilité hémodynamique et la prise en charge d’un épanchement péricardique. Cette modalité peut également s’avérer utile pour identifier et diagnostiquer les masses médiastinales14 et leur impact sur les chambres cardiaques.12,14 Toutefois, les avantages potentiels de l’échocardiographie transœsophagienne peropératoire doivent être soupesés en regard des risques de lésion œsophagienne et de compression trachéale postérieure.
La spirométrie
La mesure des débits respiratoires en positions verticale et couchée est communément recommandée dans la littérature en anesthésiologie. L’obstruction des voies aériennes au niveau intrathoracique s’accompagne d’un élargissement du plateau mi-expiratoire et certains chercheurs pensent qu’elle est un prédicteur de risque de complications peropératoires au niveau des voies aériennes.15 Bien qu’une obstruction trachéale grave soit accompagnée d’anomalies au niveau du passage de l’air chez les patients présentant des masses médiastinales,16,17 l’aplatissement classique de la portion expiratoire ne semble pas être pathognomonique d’une obstruction intrathoracique variable16 des voies aériennes; en outre, il n’a pas été démontré que cet état était un prédicteur de complications.18
Comme le suggèrent Bechard et coll. dans une série de cas chez l’adulte, l’exploration fonctionnelle respiratoire (EFR) pourrait contribuer à prédire le risque ou aider à la prise en charge périopératoire des patients présentant une masse médiastinale. Ces auteurs rapportent qu’un tableau obstructif et restrictif mixte observé lors de l’EFR prédisait un taux plus élevé de complications respiratoires postopératoires lors d’une analyse multivariée.8 Si l’on combine ces observations aux résultats d’études portant sur des populations pédiatriques, il semble que les réductions de la fonction pulmonaire sont principalement le résultat de la compression du parenchyme pulmonaire, et que celles-ci pourraient entraîner une incidence accrue de complications postopératoires telles que l’atélectasie et la pneumonie. Pour qu’une masse médiastinale soit à la fois obstructive et restrictive, elle doit être suffisamment large pour comprimer une quantité significative du parenchyme pulmonaire tout en comprimant la trachée et/ou les bronches souches. Dès lors, l’EFR peut constituer une mesure de substitut de la taille et de l’emplacement de la masse, des informations plus aisément tirées d’un tomodensitogramme thoracique. Nous ne savons toutefois pas si l’EFR améliore la stratification préopératoire du risque ou la prise en charge de l’anesthésie.
La compression de la trachée
Pour l’anesthésiologiste, des symptômes et/ou données radiographiques indiquant une compression de la trachée sont très inquiétants; en effet, on pense que cette compression est associée à un risque accru de complications peropératoires au niveau des voies aériennes. La littérature cite de nombreux exemples de patients présentant des masses médiastinales et qui ont subi des séquelles graves, voire fatales, au niveau des voies aériennes en période peropératoire. Les patients présentant une réduction > 50 % de l’aire transversale de la trachée présenteront plus probablement des symptômes6 et souffriront plus fréquemment de complications périopératoires,8,19 alors qu’une aire transversale > 50 % de la normale semble être associée à une faible incidence de complications respiratoires.17,20 Sans surprise, la limite inférieure « sécuritaire » de l’aire transversale varie d’une étude à l’autre, et d’autres limites inférieures ont été proposées.10 La stratification définitive des risques se fondant sur l’aire transversale de la trachée et d’autres facteurs prédictifs potentiels est limitée par la tendance, fort compréhensible, de la plupart des praticiens à modifier la prise en charge de l’anesthésie et à éviter complètement l’anesthésie générale chez les patients dont les résultats sont les plus inquiétants. La limite inférieure de l’aire transversale de la trachée compatible avec l’administration sécuritaire d’une anesthésie générale variera probablement selon les caractéristiques du patient, ses comorbidités (par ex. maladie respiratoire chronique), ainsi que selon la taille et la relation spatiale de la masse par rapport aux voies aériennes. La compression concomitante des bronches souches pourrait également avoir un impact significatif sur le risque périopératoire. Dans une étude récente, Hack et coll. ont observé des complications respiratoires seulement chez les enfants avec une aire transversale de la trachée < 30 % ou une aire transversale de la trachée < 70 % s’il y avait une compression bronchiale coexistante.10 En outre, il a été rapporté que la combinaison d’une compression de la bronche souche gauche et d’une compression de l’artère pulmonaire droite provoquait une discordance complète entre la ventilation et la perfusion.2,13
Le plan pour l’anesthésie
Un plan de soins périopératoires personnalisé doit être élaboré pour chaque patient selon les données disponibles, qu’elles soient cliniques, radiographiques ou autres. En outre, ce plan doit être élaboré par une équipe pluridisciplinaire et impliquer l’anesthésiologiste, le chirurgien et l’intensiviste. La participation d’un oncologue, d’un radio-oncologue, voire d’un radiologiste interventionnel dans certains cas, pourrait s’avérer cruciale. Bien qu’il ne soit pas encore possible d’évaluer avec précision le risque de complications périopératoires, il est probablement raisonnable de stratifier les patients en catégories de risque élargies selon l’association statistique de caractéristiques entraînant un risque et notre compréhension globale de la physiologie thoracique et médiastinale. De telles stratégies de stratification des risques ont déjà été proposées.3,10,15 Nous utilisons l’approche suivante pour classer les patients:
-
Risque faible: Asymptomatique ou légèrement symptomatique, sans symptômes posturaux ou données radiographiques confirmant une compression importante des structures;
-
Risque intermédiaire: Symptômes posturaux légers à modérés, compression trachéale < 50 %;
-
Risque élevé: Symptômes posturaux graves, stridor, cyanose, compression trachéale > 50 % ou compression trachéale avec compression bronchique associée, épanchement péricardique ou syndrome de la VCS.
Physiopathologie des masses médiastinales
Les conséquences physiopathologies des masses médiastinales sont principalement dues à la concurrence qu’elles livrent, dans l’espace médiastinal, à d’autres structures vitales d’un point de vue physiologique, soit le cœur, les artères pulmonaires, les grandes veines, les poumons, et les voies aériennes majeures. L’anesthésie et les interventions qui y sont associées, comme par exemple la curarisation et la ventilation en pression positive, peuvent avoir des effets substantiels sur cet équilibre. La réduction de la capacité résiduelle fonctionnelle (CRF) associée à l’anesthésie générale est d’environ 20 %,21 ce qui entraîne probablement des effets sur le tonus des muscles inspiratoires, sur le recul élastique de la paroi thoracique, et sur le déplacement du diaphragme vers le haut. La perte d’activité de ventilation spontanée réduit le gradient de pression transpleurale qui, dans des conditions normales, sert à ouvrir les voies aériennes intrathoraciques et à prévenir leur collapsus. Cela est particulièrement vrai pendant la phase expiratoire, lorsque les pressions pleurales augmentent, ce qui peut aggraver la compression des voies aériennes au site de coincement. La ventilation en pression positive pourrait exacerber encore davantage les augmentations de la pression intrathoracique associées à l’anesthésie. Cette hypothèse s’appuie sur l’observation que, chez l’humain, les pressions médiastinales sont significativement plus basses lors de modes ventilatoires où la ventilation spontanée est présente.22
Des complications hémodynamiques peuvent être provoquées par la compression des structures cardiovasculaires principales. Un débit cardiaque réduit peut être le résultat d’une compression de la VCS, des artères pulmonaires, ou du cœur lui-même. La compression antérieure directe du cœur est plus probablement liée au cœur droit, particulièrement au ventricule droit et à sa chambre de chasse, alors qu’une compression du cœur gauche vient plus probablement d’une direction postérieure.5,24 Chez un modèle canin de masse médiastinale antérieure sous anesthésie, il a été démontré que la réduction de l’index cardiaque était principalement due à une augmentation de la post-charge ventriculaire droite, dont le résultat final était une réduction du volume d’éjection ventriculaire gauche via un effet sur l’interdépendance ventriculaire.25 La compression myocardique directe peut entraîner un syndrome semblable à de la tamponnade en entravant le remplissage diastolique des chambres cardiaques, un processus qui peut être exacerbé par un épanchement péricardique coexistant, un facteur de risque de complications.8
Une compression significative d’un point de vue clinique des structures pourrait également survenir en raison de masses situées dans le médiastin postérieur. Nous savons que la compression du cœur gauche survient en raison de masses situées dans le médiastin postérieur.5,24 Les masses œsophagiennes, un œsophage dilaté, les tumeurs et autres masses situées dans le médiastin postérieur peuvent également provoquer une compression ou une déviation trachéale. Comme il n’y a pas de cartilage soutenant la paroi trachéale postérieure, celle-ci pourrait être plus susceptible à une compression rapide par des masses dans cette région, ce qui pourrait potentiellement entraîner une obstruction trachéale grave.
L’anesthésie pour les interventions diagnostiques
Étant donné que les lymphomes et autres tumeurs malignes peuvent apparaître comme des masses médiastinales et nécessiter des traitements non chirurgicaux, l’anesthésiologiste est souvent confronté au défi de fournir une anesthésie sécuritaire pour faciliter une biopsie chirurgicale. Il est important que l’anesthésiologiste soit impliqué dans les décisions portant sur les risques et avantages des approches de biopsie possibles. Pour les patients présentant un risque intermédiaire à élevé, il est raisonnable et utile d’avoir comme objectif d’éviter l’anesthésie générale et ce, jusqu’à et à moins que d’autres options n’aient été exclues.
Dans la plupart des cas, la biopsie réalisée à l’aide d’une aiguille percutanée sous guidage tomodensitométrique écarte le besoin de biopsie chirurgicale. Il est peu probable qu’une orthopnée entrave cette intervention, étant donné qu’elle peut généralement être réalisée avec une élévation de la tête à 20-30°. Toute source extrathoracique de diagnostic tissulaire, comme un épanchement pleural ou une lymphadénopathie, devrait être prélevée sous anesthésie locale. Même lorsqu’une biopsie chirurgicale est nécessaire, on peut souvent éviter une anesthésie générale. Les masses situées dans le médiastin antérieur et supérieur sont facilement accessibles par une approche de petite médiastinotomie antérieure. Cette intervention peut être réalisée sous anesthésie locale et on peut obtenir une meilleure précision diagnostique par rapport à une biopsie à l’aiguille.26 Une médiastinoscopie et une thoracoscopie peuvent également être réalisées sous anesthésie locale chez les patients motivés.27,28 Des approches consistant à éviter l’anesthésie générale et impliquant une anesthésie locale seule ou en combinaison à une sédation ont été décrites dans des séries de cas cliniques chez l’adulte8 et chez l’enfant7,10 présentant des masses médiastinales.
Il faut également envisager un traitement à base de corticostéroïdes, de chimiothérapie ou de radiothérapie avant la biopsie afin de soulager les symptômes et d’améliorer la sécurité de l’anesthésie générale. Malheureusement, un traitement empirique administré avant le diagnostic tissulaire définitif pourrait avoir un impact négatif sur le diagnostic pathologique et le succès ultime d’un traitement. Cependant, cette opinion n’est pas partagée par tous et la pratique varie d’un établissement à l’autre. Chez les patients dont les voies aériennes sont gravement atteintes et dont le traitement est non chirurgical, un pontage des voies aériennes peut être réalisé comme mesure provisoire.
La prise en charge de l’anesthésie générale
Selon les cas présentés dans la littérature, il n’y a pas de complications graves chez les patients présentant des caractéristiques de risque faible. On peut administrer une anesthésie générale de façon sécuritaire à ces patients, accompagnée de ventilation en pression positive et du monitorage standard. La prise en charge des patients à risque intermédiaire et élevé doit être personnalisée selon leurs symptômes préopératoires et les examens radiologiques. Un monitorage artériel effractif est nécessaire chez ces patients en raison du potentiel d’instabilité cardiorespiratoire. S’il existe des symptômes préopératoires de syndrome de la VCS, un accès intraveineux à grand débit doit être installé dans un membre inférieur.
Sommaire des données probantes
Nous sommes d’accord avec les auteurs9,15,29 qui ont par le passé souligné l’importance du maintien de la ventilation spontanée chez les patients à risque élevé subissant des interventions chirurgicales. Littéralement tous les cas rapportés de complications graves sont survenus en l’absence de ventilation spontanée. Cependant les présentations de cas sont, par nature, biaisées et ont tendance à se concentrer sur les patients les plus gravement affectés et, souvent, les devenirs les plus catastrophiques. En outre, l’efficacité clinique du maintien de la ventilation spontanée dans le contexte de masses médiastinales à risque élevé ne peut être testée de façon contrôlée chez les patients humains. Dès lors, les données probantes cliniques appuyant ce type de prise en charge proviennent principalement de deux sortes de données probantes : 1) les présentations et séries de cas dans lesquelles les complications cardiorespiratoires sont survenues après une curarisation et/ou une ventilation en pression positive;30-33 et 2) les comptes-rendus23,34-37 et séries8,9,17,19,33 dans lesquels les patients à risque élevé pris en charge par ventilation spontanée (anesthésie générale ou anesthésie locale avec sédation) ont évité des complications graves. Si on les combine aux principes physiologiques abordés plus haut, la majorité des données probantes appuie le maintien de la ventilation spontanée pendant l’anesthésie générale. Dans la plupart des cas, la ventilation en pression positive et la curarisation peuvent être débutés de façon sécuritaire après la décompression chirurgicale du médiastin par sternotomie.
La prise en charge des voies aériennes
Les voies aériennes peuvent être maintenues perméables en réalisant une bronchoscopie par fibre optique chez le patient éveillé à l’aide d’anesthésie locale, à laquelle on ajoutera une sédation intraveineuse judicieuse, ou après une induction par inhalation et une laryngoscopie traditionnelle. La méthode privilégiée devra minimiser les risques d’obstruction des voies aériennes supérieures, l’apnée et le laryngospasme, lesquels peuvent être néfastes en présence d’obstruction trachéo-bronchique. Lors d’épanchement péricardique important, de compression cardiaque ou d’autres complications cardiovasculaires, la ventilation spontanée pourrait ne pas suffire à contrecarrer les effets hémodynamiques d’une anesthésie profonde aux agents volatils.
La stratégie adaptée pour la prise en charge des voies aériennes sera déterminée en fonction de l’anatomie de l’obstruction trachéo-bronchique. Lors de compression trachéale avec un segment suffisant de trachée distale normale, on peut en général placer une sonde endotrachéale renforcée de taille appropriée au-delà du niveau de l’obstruction. Toutefois, si la trachée distale, la carène et/ou les deux bronches souches sont comprimées, il pourrait s’avérer impossible de passer une sonde endotrachéale au-delà de l’obstruction. Dans de tels cas, on ne peut considérer le positionnement de la sonde endotrachéale de façon proximale à l’obstruction comme une façon définitive d’assurer l’accès aux voies aériennes. Traditionnellement, on a recommandé le recours à une bronchoscopie rigide afin de garantir l’accès aux voies aériennes lorsqu’une sonde endotrachéale ne peut être positionnée plus loin que le niveau de l’obstruction. Toutefois, cette technique peut être difficile, voire impossible, chez un patient dont la colonne cervicale est immobilisée ou dont l’anatomie des voies aériennes supérieures est défavorable. Dans de tels cas à risque élevé, une planification adaptée doit envisager la possibilité de perte des voies aériennes.
La ventilation spontanée
Le maintien de la ventilation spontanée via une sonde endotrachéale doit être poursuivi tout en obtenant un niveau d’anesthésie chirurgicale. La dexmédétomidine et la kétamine, des agents intraveineux, peuvent s’avérer utiles dans un tel cas étant donné leurs propriétés analgésiques et sédatives et la dépression respiratoire minimale qui y est associée. L’anesthésiologiste doit être prêt à réaliser des manœuvres d’urgence pour libérer les voies aériennes si la ventilation devenait difficile avant la résection de la masse. Il peut par exemple éveiller rapidement le patient, le positionner dans une position de « sauvetage » prévue au préalable, ou se servir d’un bronchoscope rigide pour le ventiler.
La position de « sauvetage »
Lors de difficultés importantes rencontrées dans la ventilation du patient, on peut rapidement mettre en place une position de « sauvetage » qui pourrait améliorer les symptômes de collapsus respiratoire imminent.38,39 Idéalement, la position de « sauvetage » correcte devrait être déterminée en période préopératoire et choisie en fonction de la relation anatomique entre la masse et la structure comprimée et l’amélioration des symptômes dans certaines positions spécifiques. Parmi les positions de « sauvetage » possibles, citons la position assise à la verticale, le décubitus latéral,38,39 ou la position ventrale, selon la relation anatomique entre la masse et les voies aériennes. Le recours à un bronchoscope rigide et à un médecin compétent en la matière peut être nécessaire en cas de perte des voies aériennes. Le bronchoscope peut être positionné au-delà du rétrécissement mi-trachéal ou dans une bronche souche. L’anesthésie peut être maintenue par voie intraveineuse et la respiration spontanée maintenue ou assistée à l’aide d’une ventilation jet transtrachéale. Lors de la visualisation de l’anatomie trachéo-bronchique, on peut décider de : poursuivre la ventilation via le bronchoscope rigide, placer une sonde endotrachéale à simple ou double lumière en vision directe, ou attendre le retour de la ventilation spontanée. Une hypotension grave pourrait également justifier un changement rapide de la position en position de « sauvetage » . Des diminutions légères à modérées du débit cardiaque pourraient répondre à une profondeur moins importante de l’anesthésie et aux principes de base de la prise en charge de la tamponnade cardiaque, notamment l’expansion du volume plasmatique et/ou un traitement à base de vasopresseurs ou d’inotropes. Si ces mesures sont inefficaces, il faut réaliser immédiatement une sternotomie afin de retirer la masse des structures en péril.
L’hélium - oxygène
En cas de compression trachéo-bronchique grave, il peut y avoir une réduction du débit respiratoire, en partie due à une augmentation des turbulences distales au site d’obstruction. Les mélanges d’hélium et d’oxygène (héliox) ont été couramment utilisés chez les patients souffrant d’obstruction afin de promouvoir un débit gazeux laminaire. Le recours à l’héliox a également été décrit chez des patients présentant une obstruction critique des voies aériennes due à des masses médiastinales de grande taille, et il pourrait améliorer les symptômes37 tout en facilitant l’induction de l’anesthésie générale36,37 et le sevrage du soutien ventilatoire.40 Pour bénéficier des effets salutaires de l’héliox en matière de débit gazeux laminaire, il faut des fractions élevées d’hélium, et donc limiter la concentration inspiratoire d’oxygène. Les avantages potentiels de meilleurs débits gazeux trachéo-bronchiques distaux chez les patients dont les voies aériennes sont gravement mises en péril et/ou en détresse respiratoire doivent être soupesés en regard du désavantage de limiter la fraction d’oxygène inspiré, tout particulièrement chez les patients hypoxémiques.
La circulation extracorporelle
La dernière option dans l’algorithme de prise en charge d’une masse médiastinale grave est la circulation extracorporelle (CEC). Le temps nécessaire à réaliser une canulation d’urgence et à mettre en place une CEC totale variera probablement beaucoup en fonction de plusieurs facteurs, notamment de l’expérience du chirurgien et de degré de préparation. Bien que des comptes-rendus de CEC d’urgence entraînant le sauvetage de patients d’un collapsus hémodynamique ou respiratoire complet existent, il semble peu probable qu’on puisse compter sur une CEC totalement non planifiée dans un tel cas. Même avec un circuit de CEC prêt et un chirurgien cardiaque et un perfusionniste en salle d’opération, l’intervalle ischémique pendant la canulation d’urgence et la mise en place d’une CEC complète entraînera probablement une lésion neurologique importante.
La préparation préopératoire d’une CEC doit être envisagée chez les patients à risque très élevé. Si d’autres techniques de sauvetage ont peu de chances de réussir (par ex., compression distale sévère de la trachée et/ou des deux bronches souches), la canulation doit être faite avant l’induction de l’anesthésie. Nous ne savons pas si un niveau intermédiaire de préparation à la CEC (par ex., exposition chirurgicale des vaisseaux fémoraux ou canulation de ces vaisseaux à l’aide de canules de petit calibre afin de faciliter une canulation définitive plus rapide) peut raccourcir suffisamment l’intervalle ischémique en cas de collapsus hémodynamique ou respiratoire.
Les données probantes dont nous disposons indiquent que des complications liées à l’effet de la masse médiastinale peuvent également survenir en période postopératoire.8,10 Les pneumonies, l’obstruction des voies aériennes suite à un œdème et l’atélectasie sont les manifestations les plus courantes et ont tendance à survenir au cours des premières 48 h.8 Les masses de longue date pourraient provoquer une trachéo-malacie, causant une obstruction des voies aériennes. La résection de masses complexes de taille importante peut constituer un défi technique, nécessiter de longues périodes d’opération, et entraîner potentiellement d’importantes pertes de sang et transferts de liquides. Dans de tels cas, la prudence dicte d’envisager une période de ventilation postopératoire.
Résumé
Les patients se présentant avec une masse médiastinale antérieure de taille importante représentent un défi considérable pour les anesthésiologistes. On recommande d’éviter l’anesthésie générale pour les interventions diagnostiques, particulièrement en cas de symptômes graves. Le maintien de la ventilation spontanée avec anesthésie générale constitue la pierre angulaire de la prise en charge des patients à risque élevé. Les patients à risque élevé chez lesquels une anesthésie générale est nécessaire pour la résection doivent bénéficier d’un plan anesthésique minutieusement individualisé et comprenant plusieurs options thérapeutiques facilement accessibles afin de prévenir ou de prendre en charge toute complication cardiorespiratoire.
Cas clinique
Le consentement du patient a été obtenu pour la publication. Un homme de 49 ans a subi une discectomie cervicale antérieure et une chirurgie de fusion. Son poids était de 100 kg et il n’avait aucun antécédent médical autre que cette maladie au niveau des disques cervicaux. Il n’y avait aucun symptôme préopératoire, et aucune radiographie thoracique préopératoire n’a été réalisée. Il a reçu une anesthésie générale balancée avec curarisation et ventilation en pression positive. Le chirurgien a remarqué une grosse glande thyroïde, ce qui a compliqué l’exposition des corps vertébraux cervicaux antérieurs. Il a fallu manipuler et retirer la glande thyroïde afin de terminer l’intervention avec succès. Le patient s’est rétabli sans incident et a reçu son congé de l’hôpital. Cependant, au cinquième jour postopératoire, le patient se présente avec de la toux et de la dyspnée. Une radiographie des poumons et une tomodensitométrie révèlent une masse médiastinale antérieure de taille importante prenant son origine dans son cou, probablement un goitre médiastinal. La trachée est gravement comprimée et déviée, et la veine brachio-céphalique est également comprimée, mais il n’y a pas d’épanchement péricardique (Figs. 2, 3, 4, 5). Le patient est transféré d’urgence à l’institution des auteurs. Le patient souffre de dyspnée, de tachycardie et d’hypertension. La saturation en oxygène (SpO2) est tout d’abord de 98 % à l’air ambiant, mais au bout de quatre heures passées dans le département des urgences, il a besoin d’ oxygène à 4 L·min−1 afin de maintenir une SpO2 de 94 %. Pendant les quintes de toux fréquentes, la SpO2 diminue à < 85 %. En cas d’orthopnée grave, il faut que le patient s’assoie à la verticale. Une canule artérielle est placée dans l’artère radiale droite, révélant un pouls paradoxal de 30 mmHg. Le patient est amené d’urgence en salle d’opération pour une résection de la masse. Une sternotomie et dissection antérieure du cou sont prévues pour exciser complètement la masse.
Directives pour compléter le module de développement professionnel continu (DPC)
-
1.
Lisez cet article et les références en gras.
-
2.
Allez à : https://www.cpass2.umontreal.ca/selfassessmentprogram/ et choisissez le module actuel (La prise en charge de l’anesthésie des patients avec une masse médiastinale antérieure).
-
3.
Répondez aux questions à choix de réponses concernant le cas clinique.
-
4.
Une fois que vous avez saisi toutes vos réponses, vous aurez accès aux explications d’experts pour tous les choix possibles.
-
5.
Les participants peuvent réclamer un maximum de quatre heures de DPC pour un total de 12 crédits sous la Section 3 du programme de DPC du Collège royal des médecins et chirurgiens du Canada.
References
Harle CC, Dearlove O, Walker RW, Wright N. A bronchogenic cyst in an infant causing tracheal occlusion and cardiac arrest. Anaesthesia 1999; 54: 262-5.
Takeda S, Miyoshi S, Omori K, Okumura M, Matsuda H. Surgical rescue for life-threatening hypoxemia caused by a mediastinal tumor. Ann Thorac Surg 1999; 68: 2324-6.
Hammer GB. Anaesthetic management for the child with a mediastinal mass. Pediatr Anesth 2004; 14: 95-7.
Asai T. Emergency cardiopulmonary bypass in a patient with a mediastinal mass. Anaesthesia 2007; 62: 859-60.
Wynne J, Markis JE, Grossman W. Extrinsic compression of the heart by tumor masquerading as cardiac tamponade. Cathet Cardiovasc Diagn 1978; 4: 81-5.
Shamberger RC, Holzman RS, Griscom NT, Tarbell NJ, Weinstein HJ. CT quantitation of tracheal cross-sectional area as a guide to the surgical and anesthetic management of children with anterior mediastinal masses. J Pediatr Surg 1991; 26: 138-42.
King DR, Patrick LE, Ginn-Pease ME, McCoy KS, Klopfenstein K. Pulmonary function is compromised in children with mediastinal lymphoma. J Pediatr Surg 1997; 32: 294-9; discussion 299-300.
Bechard P, Letourneau L, Lacasse Y, Cote D, Bussieres JS. Perioperative cardiorespiratory complications in adults with mediastinal mass: incidence and risk factors. Anesthesiology 2004; 100: 826-34; discussion 825A.
Anghelescu DL, Burgoyne LL, Liu T, et al. Clinical and diagnostic imaging findings predict anesthetic complications in children presenting with malignant mediastinal masses. Pediatr Anesth 2007; 17: 1090-8.
Hack HA, Wright NB, Wynn RF. The anaesthetic management of children with anterior mediastinal masses. Anaesthesia 2008; 63: 837-46.
Radauceanu DS, Dunn JO, Lagattolla N, Farquhar-Thomson D. Temporary extracorporeal jugulosaphenous bypass for the peri-operative management of patients with superior vena caval obstruction: a report of three cases. Anaesthesia 2009; 64: 1246-9.
Redford DT, Kim AS, Barber BJ, Copeland JG. Transesophageal echocardiography for the intraoperative evaluation of a large anterior mediastinal mass. Anesth Analg 2006; 103: 578-9.
Huang YL, Yang MC, Huang CH, et al. Rescue of cardiopulmonary collapse in anterior mediastinal tumor: case presentation and review of literature. Pediatr Emerg Care 2010; 26: 296-8.
Brooker RF, Zvara DA, Roitstein A. Mediastinal mass diagnosed with intraoperative transesophageal echocardiography. J Cardiothorac Vasc Anesth 2007; 21: 257-8.
Erdos G, Tzanova I. Perioperative anaesthetic management of mediastinal mass in adults. Eur J Anaesthesiol 2009; 26: 627-32.
Vander Els NJ, Sorhage F, Bach AM, Straus DJ, White DA. Abnormal flow volume loops in patients with intrathoracic Hodgkin’s disease. Chest 2000; 117: 1256-61.
Shamberger RC, Holzman RS, Griscom NT, Tarbell NJ, Weinstein HJ, Wohl ME. Prospective evaluation by computed tomography and pulmonary function tests of children with mediastinal masses. Surgery 1995; 118: 468-71.
Hnatiuk OW, Corcoran PC, Sierra A. Spirometry in surgery for anterior mediastinal masses. Chest 2001; 120: 1152-6.
Stricker PA, Gurnaney HG, Litman RS. Anesthetic management of children with an anterior mediastinal mass. J Clin Anesth 2010; 22: 159-63.
Shamberger RC. Preanesthetic evaluation of children with anterior mediastinal masses. Semin Pediatr Surg 1999; 8: 61-8.
Wahba RW. Perioperative functional residual capacity. Can J Anaesth 1991; 38: 384-400.
Navarrete-Navarro P, Vazquez G, Fernandez E, Torres JM, Reina A, Hinojosa R. Mediastinal, left, and right atrial pressure variations with different modes of mechanical and spontaneous ventilation. Crit Care Med 1989; 17: 563-6.
Abdelmalak B, Marcanthony N, Abdelmalak J, Machuzak MS, Gildea TR, Doyle DJ. Dexmedetomidine for anesthetic management of anterior mediastinal mass. J Anesth 2010; 24: 607-10.
Mates M, Veselka J, Belohlavek J. Esophageal achalasia compressing the heart diagnosed by echocardiography. Int J Cardiol 1998; 66: 225-7.
Johnson D, Hurst T, Cujec B, Mayers I. Cardiopulmonary effects of an anterior mediastinal mass in dogs anesthetized with halothane. Anesthesiology 1991; 74: 725-36.
Watanabe M, Takagi K, Aoki T, et al. A comparison of biopsy through a parasternal anterior mediastinotomy under local anesthesia and percutaneous needle biopsy for malignant anterior mediastinal tumors. Surg Today 1998; 28: 1022-6.
Pompeo E, Tacconi F, Mineo TC. Awake video-assisted thoracoscopic biopsy in complex anterior mediastinal masses. Thorac Surg Clin 2010; 20: 225-33.
Rendina EA, Venuta F, De Giacomo T, et al. Biopsy of anterior mediastinal masses under local anesthesia. Ann Thorac Surg 2002; 74: 1720-2; discussion 1722-3.
Gothard JW. Anesthetic considerations for patients with anterior mediastinal masses. Anesthesiol Clin 2008; 26: 305-14.
Neuman GG, Weingarten AE, Abramowitz RM, Kushins LG, Abramson AL, Ladner W. The anesthetic management of the patient with an anterior mediastinal mass. Anesthesiology 1984; 60: 144-7.
Hall KD, Friedman M. Extracorporeal oxygenation for induction of anesthesia in a patient with an intrathoracic tumor. Anesthesiology 1975; 42: 493-5.
Goh MH, Liu XY, Goh YS. Anterior mediastinal masses: an anaesthetic challenge. Anaesthesia 1999; 54: 670-4.
Ng A, Bennett J, Bromley P, Davies P, Morland B. Anaesthetic outcome and predictive risk factors in children with mediastinal tumours. Pediatr Blood Cancer 2007; 48: 160-4.
Dilworth K, Thomas J. Anaesthetic consequences for a child with complex multilevel airway obstruction – recommendations for avoiding life-threatening sequelae. Pediatr Anesth 2003; 13: 620-3.
Capdeville M. The management of a patient with tracheal compression undergoing combined resection of an anterior mediastinal mass and aortic valve replacement with coronary artery bypass graft surgery: utility of the laryngeal mask airway and Aintree intubation catheter. J Cardiothorac Vasc Anesth 2007; 21: 259-61.
Polaner DM. The use of heliox and the laryngeal mask airway in a child with an anterior mediastinal mass. Anesth Analg 1996; 82: 208-10.
Galway U, Doyle DJ, Gildea T. Anesthesia for endoscopic palliative management of a patient with a large anterior mediastinal mass. J Clin Anesth 2009; 21: 150-1.
Choi WJ, Kim YH, Mok JM, Choi SI, Kim HS. Patient repositioning and the amelioration of airway obstruction by an anterior mediastinal tumor during general anesthesia - a case report. Korean J Anesthesiol 2010; 59: 206-9.
Cho Y, Suzuki S, Yokoi M, Shimada M, Kuwabara S, Murayama A. Lateral position prevents respiratory occlusion during surgical procedure under general anesthesia in the patient of huge anterior mediastinal lymphoblastic lymphoma. Jpn J Thorac Cardiovasc Surg 2004; 52: 476-9.
Bigham MT, Nowak JE, Wheeler DS. Therapeutic application of helium-oxygen and mechanical ventilation in a child with acute myelogenous leukemia and airway obstruction. Pediatr Emerg Care 2009; 25: 469-72.
Funding sources
This work is supported by institutional funding from the Department of Anesthesiology, University of Virginia Health System.
Conflict of interest
None declared.
Author information
Authors and Affiliations
Corresponding author
Rights and permissions
About this article
Cite this article
Blank, R.S., de Souza, D.G. Anesthetic management of patients with an anterior mediastinal mass: Continuing Professional Development. Can J Anesth/J Can Anesth 58, 853–867 (2011). https://doi.org/10.1007/s12630-011-9539-x
Received:
Accepted:
Published:
Issue Date:
DOI: https://doi.org/10.1007/s12630-011-9539-x